 |
 |
| ├ļÓŌĒÓ | ęÕ±“¹ ┼├▌ | ╩ĒĶŃĶ | ąÕ±¾±¹ | ┬Õß-ĻÓ“ÓļŅŃ | įŅ¾ņ | ╬ ’Ņ“ÓļÕ |
±ÕŃŅõĒ : „Õ“ŌÕŃ, 2 ņÓ 2024
|
||||||||||||
±ÕŃŅõĒ : „Õ“ŌÕŃ, 2 ņÓ 2024
|
||||||||||||
|
▌ļÕĻ“ŅĒĒÓ ßĶßļĶŅ“ÕĻÓ
ą£ąĄą┤čī, čüąĄčĆąĄą▒čĆąŠ
ąØąĢą×ąĀąōąÉąØąśą¦ąĢąĪąÜąÉą» ąźąśą£ąśą». ąŁąøąĢą£ąĢąØąóą½ ąś ąśąź ąĪą×ąĢąöąśąØąĢąØąśą»14. ą£ąĄą┤čī, čüąĄčĆąĄą▒čĆąŠąĪą▓ąŠą╣čüčéą▓ą░ 菹╗ąĄą╝ąĄąĮč鹊ą▓ I B ą│čĆčāą┐ą┐čŗ.
ą£ąĄą┤čī. ążąĖąĘąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░. ą£ąĄą┤čī ŌĆö ą┤ąŠą▓ąŠą╗čīąĮąŠ ą╝čÅą│ą║ąĖą╣ ą╝ąĄčéą░ą╗ą╗ ą║čĆą░čüąĮąŠ-ąČąĄą╗č鹊ą│ąŠ čåą▓ąĄčéą░. ąĢąĄ ą░č鹊ą╝čŗ ąĖą╝ąĄčÄčé 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą║ąŠąĮčäąĖą│čāčĆą░čåąĖčÄ ą▓ąĮąĄčłąĮąĄą│ąŠ čāčĆąŠą▓ąĮčÅ 3d104s1. ą£ąĄą┤čī ŌĆö ą┤ąŠą▓ąŠą╗čīąĮąŠ ą╝čÅą│ą║ąĖą╣ ą╝ąĄčéą░ą╗ą╗ ą║čĆą░čüąĮąŠ-ąČąĄą╗č鹊ą│ąŠ čåą▓ąĄčéą░. ąĢąĄ ą░č鹊ą╝čŗ ąĖą╝ąĄčÄčé 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą║ąŠąĮčäąĖą│čāčĆą░čåąĖčÄ ą▓ąĮąĄčłąĮąĄą│ąŠ čāčĆąŠą▓ąĮčÅ 3d104s1. ąźąĖą╝ąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░. ą£ąĄą┤čī ąŠą▒ą╗ą░ą┤ą░ąĄčé ąĮą░ąĖą╝ąĄąĮčīčłąĄą╣ ą░ą║čéąĖą▓ąĮąŠčüčéčīčÄ čüčĆąĄą┤ąĖ ą▓čüąĄčģ ą┐ąĄčĆąĄčģąŠą┤ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓. ąóą░ą║, ąŠąĮą░ ąĮąĄ čĆąĄą░ą│ąĖčĆčāąĄčé čü čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗą╝ąĖ čüąŠą╗čÅąĮąŠą╣ ąĖ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéą░ą╝ąĖ. ą×ąĮą░ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ č鹊ą╗čīą║ąŠ ą▓ ą║ąĖčüą╗ąŠčéą░čģ-ąŠą║ąĖčüą╗ąĖč鹥ą╗čÅčģ: ą£ąĄą┤čī ąŠą▒ą╗ą░ą┤ą░ąĄčé ąĮą░ąĖą╝ąĄąĮčīčłąĄą╣ ą░ą║čéąĖą▓ąĮąŠčüčéčīčÄ čüčĆąĄą┤ąĖ ą▓čüąĄčģ ą┐ąĄčĆąĄčģąŠą┤ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓. ąóą░ą║, ąŠąĮą░ ąĮąĄ čĆąĄą░ą│ąĖčĆčāąĄčé čü čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗą╝ąĖ čüąŠą╗čÅąĮąŠą╣ ąĖ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéą░ą╝ąĖ. ą×ąĮą░ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ č鹊ą╗čīą║ąŠ ą▓ ą║ąĖčüą╗ąŠčéą░čģ-ąŠą║ąĖčüą╗ąĖč鹥ą╗čÅčģ: 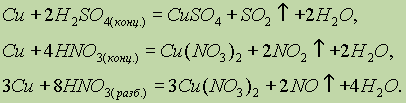 ąÆ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅčģ ą╝ąĄą┤čī ą┐čĆąŠčÅą▓ą╗čÅąĄčé ą┤ą▓ąĄ čüč鹥ą┐ąĄąĮąĖ ąŠą║ąĖčüą╗ąĄąĮąĖčÅ: 1+ ąĖ 2+, ąĖąĘ ą║ąŠč鹊čĆčŗčģ ą▒ąŠą╗ąĄąĄ čāčüč鹊ą╣čćąĖą▓ąŠ čüąŠčüč鹊čÅąĮąĖąĄ 2+. ą×ą┤ąĮąŠą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ąĄą┤čī ą▓čüčéčĆąĄčćą░ąĄčéčüčÅ ą╗ąĖą▒ąŠ ą▓ ąĮąĄčĆą░čüčéą▓ąŠčĆąĖą╝čŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅčģ (CuCl, Cu2S),(CuCl, Cu2S), ą╗ąĖą▒ąŠ ą▓ ą▓ąĖą┤ąĄ čĆą░čüčéą▓ąŠčĆąĖą╝čŗčģ ą║ąŠą╝ą┐ą╗ąĄą║čüąŠą▓ čéąĖą┐ą░ [Cu(NH3)2]+.[Cu(NH3)2]+. ą×ą┤ąĮąŠą▓ą░ą╗ąĄąĮčéąĮą░čÅ ą╝ąĄą┤čī ą▓čüčéčĆąĄčćą░ąĄčéčüčÅ ą╗ąĖą▒ąŠ ą▓ ąĮąĄčĆą░čüčéą▓ąŠčĆąĖą╝čŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅčģ (CuCl, Cu2S),(CuCl, Cu2S), ą╗ąĖą▒ąŠ ą▓ ą▓ąĖą┤ąĄ čĆą░čüčéą▓ąŠčĆąĖą╝čŗčģ ą║ąŠą╝ą┐ą╗ąĄą║čüąŠą▓ čéąĖą┐ą░ [Cu(NH3)2]+.[Cu(NH3)2]+.ąźą╗ąŠčĆąĖą┤ ą╝ąĄą┤ąĖ (I) čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą░ą╝ą╝ąĖą░ą║ą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąŠą│ąŠ ąĖąŠąĮą░ ą┤ąĖą░ą╝ą╝ąĖąĮą╝ąĄą┤ąĖ (I) [Cu(NH3)2]+: čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą░ą╝ą╝ąĖą░ą║ą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąŠą│ąŠ ąĖąŠąĮą░ ą┤ąĖą░ą╝ą╝ąĖąĮą╝ąĄą┤ąĖ (I) [Cu(NH3)2]+: ąóą░ą║ ąČąĄ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ąŠą║čüąĖą┤ ą╝ąĄą┤ąĖ (I) Cu2O: (I) Cu2O: ąśąŠąĮčŗ ąĪąĖ2+ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ čüčāčēąĄčüčéą▓čāčÄčé ą▓ ą▓ąĖą┤ąĄ ą║ąŠą╝ą┐ą╗ąĄą║čüąŠą▓ ą│ąĄą║čüą░ą░ą║ą▓ą░ą╝ąĄą┤ąĖ (II) [Cu(H2O)6]2+, ąĖą╝ąĄčÄčēąĖčģ čģą░čĆą░ą║č鹥čĆąĮčāčÄ čüąĖąĮąĄ-ą│ąŠą╗čāą▒čāčÄ ąŠą║čĆą░čüą║čā. ą¤čĆąĖ ą┤ąŠą▒ą░ą▓ą╗ąĄąĮąĖąĖ ą│ąĖą┤čĆąŠą║čüąĖą┤ą░ ąĮą░čéčĆąĖčÅ ą║ čĆą░čüčéą▓ąŠčĆčā, čüąŠą┤ąĄčƹȹ░čēąĄą╝čā čŹčéąĖ ąĖąŠąĮčŗ, ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą│ąŠą╗čāą▒ąŠą╣ ąŠčüą░ą┤ąŠą║ ą│ąĖą┤čĆą░čéąĖčĆąŠą▓ą░ąĮąĮąŠą│ąŠ ą│ąĖą┤čĆąŠą║čüąĖą┤ą░ ą╝ąĄą┤ąĖ (II): 2+ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ čüčāčēąĄčüčéą▓čāčÄčé ą▓ ą▓ąĖą┤ąĄ ą║ąŠą╝ą┐ą╗ąĄą║čüąŠą▓ ą│ąĄą║čüą░ą░ą║ą▓ą░ą╝ąĄą┤ąĖ (II) [Cu(H2O)6]2+, ąĖą╝ąĄčÄčēąĖčģ čģą░čĆą░ą║č鹥čĆąĮčāčÄ čüąĖąĮąĄ-ą│ąŠą╗čāą▒čāčÄ ąŠą║čĆą░čüą║čā. ą¤čĆąĖ ą┤ąŠą▒ą░ą▓ą╗ąĄąĮąĖąĖ ą│ąĖą┤čĆąŠą║čüąĖą┤ą░ ąĮą░čéčĆąĖčÅ ą║ čĆą░čüčéą▓ąŠčĆčā, čüąŠą┤ąĄčƹȹ░čēąĄą╝čā čŹčéąĖ ąĖąŠąĮčŗ, ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą│ąŠą╗čāą▒ąŠą╣ ąŠčüą░ą┤ąŠą║ ą│ąĖą┤čĆą░čéąĖčĆąŠą▓ą░ąĮąĮąŠą│ąŠ ą│ąĖą┤čĆąŠą║čüąĖą┤ą░ ą╝ąĄą┤ąĖ (II): ą¤ąŠą╗čāč湥ąĮąĮčŗą╣ ąŠčüą░ą┤ąŠą║, ą▓ čüą▓ąŠčÄ ąŠč湥čĆąĄą┤čī, čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ą░ą╝ą╝ąĖą░ą║ą░, ąŠą▒čĆą░ąĘčāčÅ čÅčĆą║ąŠ-čüąĖąĮąĖą╣ ą║ąŠą╝ą┐ą╗ąĄą║čü: ąśąĘą╝ąĄąĮąĄąĮąĖąĄ ąŠą║čĆą░čüą║ąĖ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ą╝ąĄą┤ąĖ ą┐čĆąĖ ą┐ąĄčĆąĄčģąŠą┤ąĄ ąĖąĘ čüč鹥ą┐ąĄąĮąĖ ąŠą║ąĖčüą╗ąĄąĮąĖčÅ 2+ ą▓ čüč鹥ą┐ąĄąĮčī ąŠą║ąĖčüą╗ąĄąĮąĖčÅ 1+ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ ą┤ą╗čÅ ą║ą░č湥čüčéą▓ąĄąĮąĮąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░. ąóą░ą║, čüą▓ąĄąČąĄąŠčüą░ąČą┤ąĄąĮąĮčŗą╣ ą│ąĖą┤čĆąŠą║čüąĖą┤ ąĪąĖ(ą×ąØ)2 čüąĖąĮąĄą│ąŠ čåą▓ąĄčéą░ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░ąĄčéčüčÅ ą┤ąŠ ąŠčĆą░ąĮąČąĄą▓ąŠą│ąŠ ąŠčüą░ą┤ą║ą░ ąĪu2ą× ą░ą╗čīą┤ąĄą│ąĖą┤ą░ą╝ąĖ ąĖą╗ąĖ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░čÄčēąĖą╝ąĖ čāą│ą╗ąĄą▓ąŠą┤ą░ą╝ąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą│ą╗čÄą║ąŠąĘąŠą╣. 2 čüąĖąĮąĄą│ąŠ čåą▓ąĄčéą░ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░ąĄčéčüčÅ ą┤ąŠ ąŠčĆą░ąĮąČąĄą▓ąŠą│ąŠ ąŠčüą░ą┤ą║ą░ ąĪu2ą× ą░ą╗čīą┤ąĄą│ąĖą┤ą░ą╝ąĖ ąĖą╗ąĖ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░čÄčēąĖą╝ąĖ čāą│ą╗ąĄą▓ąŠą┤ą░ą╝ąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą│ą╗čÄą║ąŠąĘąŠą╣. ąĪąĄčĆąĄą▒čĆąŠ. ąźąĖą╝ąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░. ąĪąĄčĆąĄą▒čĆąŠ, čéą░ą║ ąČąĄ ą║ą░ą║ ąĖ ą╝ąĄą┤čī, ąĮąĄ čĆąĄą░ą│ąĖčĆčāąĄčé čü čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗą╝ąĖ čüąŠą╗čÅąĮąŠą╣ ąĖ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéą░ą╝ąĖ, ąĮąŠ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ ą║ąĖčüą╗ąŠčéą░čģ-ąŠą║ąĖčüą╗ąĖč鹥ą╗čÅčģ: 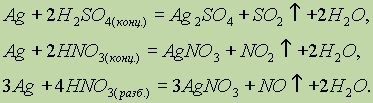 ąĪąĄčĆąĄą▒čĆąŠ, čéą░ą║ ąČąĄ ą║ą░ą║ ąĖ ą╝ąĄą┤čī, ąĮąĄ čĆąĄą░ą│ąĖčĆčāąĄčé čü čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗą╝ąĖ čüąŠą╗čÅąĮąŠą╣ ąĖ čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠčéą░ą╝ąĖ, ąĮąŠ čĆą░čüčéą▓ąŠčĆčÅąĄčéčüčÅ ą▓ ą║ąĖčüą╗ąŠčéą░čģ-ąŠą║ąĖčüą╗ąĖč鹥ą╗čÅčģ: 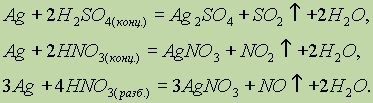 ąÆ ą▒ąŠą╗čīčłąĖąĮčüčéą▓ąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ čüąĄčĆąĄą▒čĆąŠ ą┐čĆąŠčÅą▓ą╗čÅąĄčé čüč鹥ą┐ąĄąĮčī ąŠą║ąĖčüą╗ąĄąĮąĖčÅ 1+. ąĀą░čüčéą▓ąŠčĆąĖą╝čŗą╣ ąĮąĖčéčĆą░čé čüąĄčĆąĄą▒čĆą░ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą║ą░ą║ čĆąĄą░ą║čéąĖą▓ ą┤ą╗čÅ ą║ą░č湥čüčéą▓ąĄąĮąĮąŠą│ąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÅ ąĖąŠąĮąŠą▓ ąĪl- , ąÆr- , I- : ąĀą░čüčéą▓ąŠčĆąĖą╝čŗą╣ ąĮąĖčéčĆą░čé čüąĄčĆąĄą▒čĆą░ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą║ą░ą║ čĆąĄą░ą║čéąĖą▓ ą┤ą╗čÅ ą║ą░č湥čüčéą▓ąĄąĮąĮąŠą│ąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÅ ąĖąŠąĮąŠą▓ ąĪl- , ąÆr- , I- : ą¤čĆąĖ ą┤ąŠą▒ą░ą▓ą╗ąĄąĮąĖąĖ NaOH ą║ čĆą░čüčéą▓ąŠčĆčā AgNO3 ąŠą▒čĆą░ąĘčāąĄčéčüčÅ č鹥ą╝ąĮąŠ-ą║ąŠčĆąĖčćąĮąĄą▓čŗą╣ ąŠčüą░ą┤ąŠą║ ąŠą║čüąĖą┤ą░ čüąĄčĆąĄą▒čĆą░ Ag2O: Ag2O: NaOH ą║ čĆą░čüčéą▓ąŠčĆčā AgNO3 ąŠą▒čĆą░ąĘčāąĄčéčüčÅ č鹥ą╝ąĮąŠ-ą║ąŠčĆąĖčćąĮąĄą▓čŗą╣ ąŠčüą░ą┤ąŠą║ ąŠą║čüąĖą┤ą░ čüąĄčĆąĄą▒čĆą░ Ag2O: Ag2O: ą¤ąŠą┤ąŠą▒ąĮąŠ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅą╝ ą╝ąĄą┤ąĖ (I), ąŠčüą░ą┤ą║ąĖ AgCl ąĖ Ag2O ą╝ąŠą│čāčé čĆą░čüčéą▓ąŠčĆčÅčéčīčüčÅ ą▓ čĆą░čüčéą▓ąŠčĆą░čģ ą░ą╝ą╝ąĖą░ą║ą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮčŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣: AgCl ąĖ Ag2O ą╝ąŠą│čāčé čĆą░čüčéą▓ąŠčĆčÅčéčīčüčÅ ą▓ čĆą░čüčéą▓ąŠčĆą░čģ ą░ą╝ą╝ąĖą░ą║ą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮčŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣: 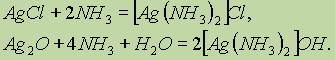 ą¤ąŠčüą╗ąĄą┤ąĮąĖą╣ ą║ąŠą╝ą┐ą╗ąĄą║čü ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ ą▓ ą║ą░č湥čüčéą▓ąĄąĮąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ ąĮą░ ą░ą╗čīą┤ąĄą│ąĖą┤čŗ (čĆąĄą░ą║čåąĖčÅ ŌĆ£čüąĄčĆąĄą▒čĆčÅąĮąŠą│ąŠ ąĘąĄčĆą║ą░ą╗ą░ŌĆØ). |
═Ó°Ķ ĒÓŃÓõ¹:
õĶ’ļŅņ įÕ±“ĶŌÓļ "═ŅŌÓ ąÕÓļ³ĒŅ±“³-2006" ļÓ¾Õ“ 1 ’ÕņĶĶ "ŪŌĖńõ¹ ęÓ“ĒÕ“Ó-2007"
═ÕõÕļ ŅßÓńŅŌÓĒĶ ŌńŅ±ļ¹§-2010
═ÕõÕļ ŅßÓńŅŌÓĒĶ ŌńŅ±ļ¹§-2010 ŽļÓĒ ņÕŅ’Ķ “Ķķ ╦ĶņÕĶĻ±ĻÓ õÕĻļÓÓ÷Ķ V Õ±’¾ßļĶĻÓĒ±ĻĶķ ╚Ē“ÕĒÕ“-’Õõ±ŅŌÕ“ ŽĶĻÓń Ņ ’ŅŌÕõÕĒĶĶ ęÕņ¹ õļ Ņß±¾µõÕĒĶ ŽļÓĒ ’ŅŌÕõÕĒĶ ╠Ó“ÕĶÓļ¹ ¾„Ķ“ÕļÕķ ╬“ “ÕŅĶĶ Ļ ’ÓĻ“ĶĻÕ (ŌĶõÕŅ) 90-ļÕ“ĶÕ ŅßÓńŅŌÓĒĶ ęÓ“Ó±ĻŅķ └ččą ŽÕ±ŅĒÓļĶĶ: ŽÕõ±ÕõÓ“ÕļĶ ’ÓŌĶ“Õļ³±“ŌÓ ŽÕ±ŅĒÓļĶĶ: ═ÓĻŅņ’Ņ±¹ ŽÕ±ŅĒÓļĶĶ: ┬¹õÓ■∙ĶÕ± õÕ “ÕļĶ Ķ±“ŅĶĶ “Ó“Ó±ĻŅŃŅ ĒÓŅõÓ šš Ō. ŽÕ±ŅĒÓļĶĶ: ŽÕõ±ÕõÓ“ÕļĶ ęÓ“ų╚╩Ó Ķ ŽÕńĶõĶ¾ņÓ ┬Õ§ŅŌĒŅŃŅ čŅŌÕ“Ó ę└ččą ŽÕ±ŅĒÓļĶĶ: ŽÕŌ¹Õ ±ÕĻÕ“ÓĶ ęÓ“Ó±ĻŅŃŅ ŅßĻŅņÓ, Õ±ĻŅņÓ ’Ó“ĶĶ ╚±“ŅĶ : Ņ¶Ķ÷ĶÓļ³Ē¹Õ õŅĻ¾ņÕĒ“¹ ┬Õ§Ķ Ķ±“ŅĶĶ šŅĒĶĻÓ Ķ±“ŅĶĶ ę└ččą įŅ“ŅŃÓ¶ĶĶ ŽŅ¶Ķļ³ĒŅÕ Ņß¾„ÕĒĶÕ Ō ±ÕõĒÕķ °ĻŅļÕ čŅõÕµÓĒĶÕ Ķ ±Ņ’ŅŌŅµõÕĒĶÕ ═ŅņÓ“ĶŌĒŅÕ ŅßÕ±’Õ„ÕĒĶÕ įŅņ¹ Ķ“ŅŃŅŌŅķ Ó““Õ±“Ó÷ĶĶ ╠ÕŅ’Ķ “Ķ įŅ¾ņ¹ 2010 ąÓ±’Ķ±ÓĒĶÕ ¶Ņ¾ņŅŌ ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ņÓ“ÕņÓ“ĶĻÕ ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ¾±±ĻŅņ¾ ń¹Ļ¾ ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ßĶŅļŅŃĶĶ Ķ §ĶņĶĶ ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ¶ĶńĶĻÕ (16 - 17 ¶ÕŌÓļ 2010 Ń.) ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ĶĒŅ±“ÓĒĒ¹ņ ń¹ĻÓņ (25 - 26 ¶ÕŌÓļ 2010 Ń.) ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ĶĒ¶ŅņÓ“ĶĻÕ (2 - 3 ņÓ“Ó 2010 Ń.) ╚Ē“ÕĒÕ“-¶Ņ¾ņ ’Ņ ŃÕŅŃÓ¶ĶĶ (4 - 5 ņÓ“Ó 2010 Ń.) Ų¾ĒÓļ "╚Ē¶ŅņÓ“ĶńÓ÷Ķ ŅßÓńŅŌÓĒĶ . ŽŅßļÕņ¹ Ķ ’ŅĶ±ĻĶ" č“Ó“³Ķ µ¾ĒÓļÓ "╚Ē¶ŅņÓ“ĶńÓ÷Ķ ŅßÓńŅŌÓĒĶ . ŽŅßļÕņ¹ Ķ ’ŅĶ±ĻĶ" Ž¾ßļĶ„Ē¹Õ ļÕĻ÷ĶĶ ╬ß∙Ó ĶĒ¶ŅņÓ÷Ķ 2007/2008 2008/2009 2009/2010 III Ņ“Ļ¹“¹ķ ĻŅĒĻ¾± ĶĒ“ÕĒÕ“ ±Óķ“ŅŌ čÓķ“¹-¾„Ó±“ĒĶĻĶ ŽĶĻÓń Ņ ’ŅŌÕõÕĒĶĶ ╠ÕŅ’Ķ “Ķ ąÕ±’¾ßļĶĻÓĒ±ĻŅÕ ÓŌŃ¾±“ŅŌ±ĻŅÕ ±ŅŌÕ∙ÓĒĶÕ ÓßŅ“ĒĶĻŅŌ ŅßÓńŅŌÓĒĶ Ķ ĒÓ¾ĻĶ 2009 IV ąÕ±’¾ßļĶĻÓĒ±ĻĶķ ╚Ē“ÕĒÕ“-’Õõ±ŅŌÕ“ IV ąÕ±’¾ßļĶĻÓĒ±ĻŅķ ĶĒ“ÕĒÕ“-ÓĻ÷Ķ "═ÕõÕļ ŅßÓńŅŌÓĒĶ ŌńŅ±ļ¹§" ╚Ē¶ŅņÓ÷Ķ Ņ ĒÕõÕļÕ ŅßÓńŅŌÓĒĶ ŌńŅ±ļ¹§ ŽŅŌ¹°ÕĒĶÕ ĻŌÓļĶ¶ĶĻÓ÷ĶĶ ’Ņ ╚╩ę ═Ņ¾“ß¾Ļ ¾„Ķ“Õļ . ╬±ĒŅŌ¹ ÓßŅ“¹ ŽŅŃÓņņÓ Intel "╬ß¾„ÕĒĶÕ õļ ß¾õ¾∙ÕŃŅ" ŽŅŃÓņņÓ "ė„Ķņ± ± Intel" ╩ÓļÕķõŅ±ĻŅ’ 

|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|